欙鳇茽餐新闻网
肠道被称为人体的“第二大脑”,其内有着数万亿微生物,不但协助消化食物,更在免疫系统塑造中扮演枢纽脚色。这些微生物经过开释各类份子与宿主“对话”,调控免疫细胞的发展与功能。但一个核心谜题一直未解:宿主可否在如此复杂的微生物群落当选择性识别并管理特定细菌?
5月14日,在《自然》期刊揭橥的一项研究中,我国科学院上海营养与健康研究所钱友存研究组,团结我国科学院份子细胞科学卓越立异中央宋昕阳研究组成功破解了这一难题。自2014年抽芽的课题历经11年末获突破性进展,这项研究首次阐明,宿主蛋白如同“扫描仪读取条形码”一样平常,可以或许专门识别细菌细胞膜上的非凡脂质“标记”,触发有益的免疫反应。
研究团队采用先进的蛋白质组学技术,比拟无菌小鼠与普通小鼠的肠道黏膜样本,发现一种名为APOL9的蛋白在普通小鼠肠道中明显高表达,且主要由肠上皮细胞发生。经过独创的“APOL9-seq”技术(结合流式细胞术与微生物组测序),研究团队意外发现,APOL9及其人类同源蛋白APOL2能特异性结合一类常见的肠道细菌——拟杆菌目(Bacteroidales)。
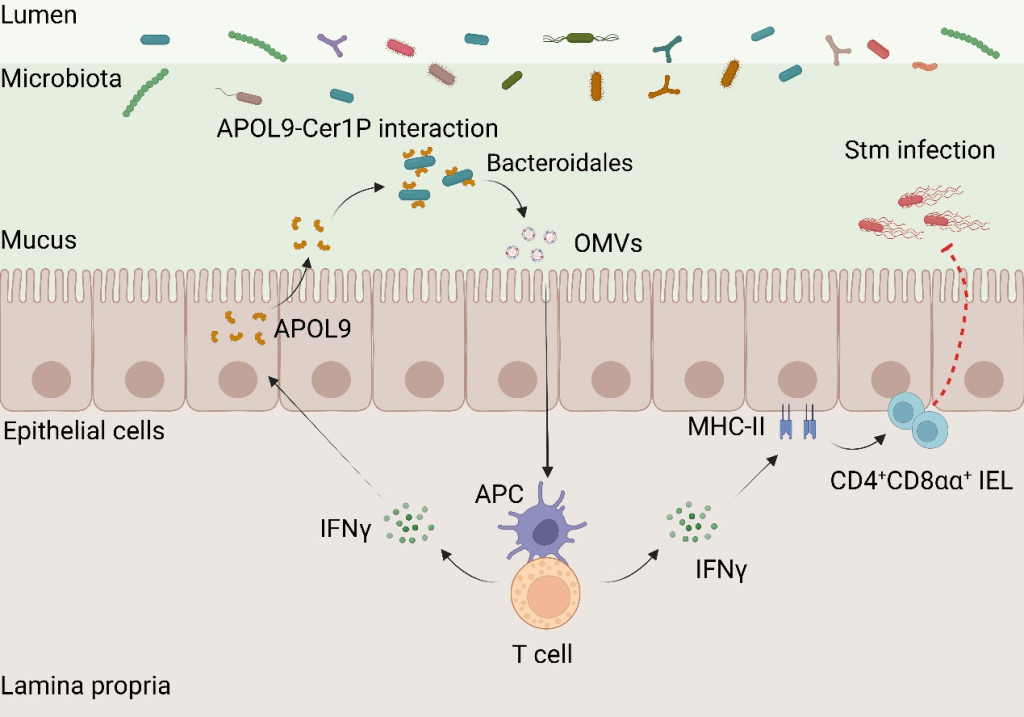
新型载脂蛋白APOL9经过结合拟杆菌Cer1P份子诱导OMVs开释并激活IFN-γ-MHC-II通路以加强肠道黏膜免疫 我国科学院上海营养与健康研究所 供图
更深切的机制研究表明,APOL9的识别能力依赖于细菌表面一种非凡的脂质份子神经酰胺-1-磷酸(Cer1P)。当经过基因编纂去除份子合成通路后,APOL9与细菌就不再结合。该研究首次证实,宿主能经过细菌特征性脂质标记,实现选择性“身份识别”。与传统抗菌蛋白不同,APOL9并不杀死目标细菌,而是诱导其开释外膜囊泡(OMVs)——这些纳米级囊泡满载细菌份子,可被宿主免疫系统捕捉并用于加强免疫防御。
北京大学基础医学院副院长、传授、博士生导师姜长涛认为,该研究颠覆了传统抗菌蛋白直接杀菌的认知范式,提出宿主经过APOL蛋白选择性靶向共生菌脂质成分,将其转化为免疫激活信号的新形式。这一发现为肠道感染、炎症性肠病等疾病的治疗提供了新思路。
一种自动塑造菌群的新范式由此被揭示——宿主并不是主动容忍微生物,而是可以经过自动的份子“对话”实现肠道微生态的静态平衡。该发现为开发“菌群-免疫”协同调控的下一代疗法拓荒了新途径,有望让未来的微生物治疗更加精确。
这项研究也再次证实,肠道不但是消化吸收的场合,更是宿主与微生物共同编织的周密免疫网络的核心。破译其中的份子密码,将为人类健康带来深远影响。论文通信作者、我国科学院上海营养与健康研究所钱友存研究员表示,未来设计进一步探索人类APOL2蛋白的功能,以及如何经过调控这一通路加强肠道免疫屏蔽。
公布于:上海市